Analytik von Pyrrolizidinalkaloiden in Gewürzen, Kräutern, Nahrungsergänzungsmitteln und pflanzlichen Arzneimitteln
1,2-ungesättigte Pyrrolizidinalkaloide (PA) und ihre N-Oxide sind sekundäre Pflanzeninhaltsstoffe mit hoher Toxizität für Mensch und Tier. Für pflanzliche Arzneimittel wurden bereits 2016 Grenzwerte etabliert. Für Lebensmittel legt nun die Verordnung (EU) 2020/2040 Limits fest. Besonders zu beachten ist dabei der erweiterte Prüfumfang.

Vorkommen
Bisher wurden PA in ca. 350 Pflanzenarten beschrieben. Auf Basis chemotaxonomischer Überlegungen wird ihr Vorkommen in ca. 6.000 Pflanzenarten vermutet. Besonders verbreitet sind PA in den Familien Boraginaceae, Asteraceae (Triben Senecionae und Eupatoriae) und Fabaceae (Gattung Crotalaria). In einzelnen Pflanzenorganen liegen PA in Konzentrationen im einstelligen Prozentbereich vor.
PA dienen den Pflanzen überwiegend zur Verteidigung gegen Tierfraß. PA-bildende Pflanzen weisen ein charakteristisches PA-Spektrum auf, welches typisch für die Familie, Gattung oder auch einzelne Arten ist. Die in einer Probe als Kontaminanten gefundenen PA lassen daher Rückschlüsse auf die ursächlichen Beikrautarten zu.
Struktur und Klassifizierung
PA sind Mono- oder Diester des 1-hydroxymethyl-pyrrolizidins (Necin-Base) mit aliphytischen mono- oder Dicarbonsäuren (Necinsäuren) mit einer Kettelänge von 5-10 C-Atomen. Nach Art und Positionierung der Veresterung(en) unterscheidet man verschiedene Strukturtypen: Monoester, offenkettige Diester und zyklische Diester. Abhängig von Sättigungsgrad und Stereochemie der Necinbase werden vier Grundtypen definiert (Abb.). Bis heute wurden ca. 600 verschiedene PA im Pflanzenreich beschrieben.
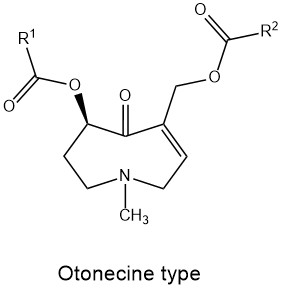
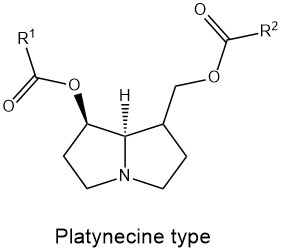
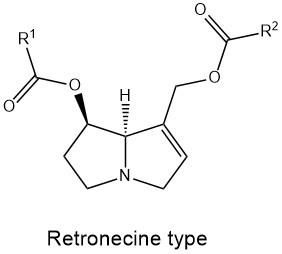
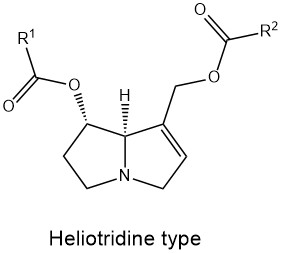
Sicherheitsbewertung
1,2-ungesättigte Pyrrolizidinalkaloide werden als genotoxische Karzinogene eingestuft. Die IARC (International Association for Research on Cancer) bewertet PA als „possibly carcinogenic to humans (group 2b). Ein TDI (Tolerable Daily Intake) kann daher aufgrund der maßgeblichen toxikologischen Modelle nicht abgeleitet werden. Daher wird auf Basis der BMDL10 ein MoE (Margin of Exposure) von 10.000 oder größer als Sicherheitsabstand empfohlen (EFSA 2011, 2017). Dieser gilt für die Langzeitexposition, wie sie bei Lebensmitteln zu Grunde gelegt wird.
Neben der genotoxischen und karzinogenen Langzeitwirkung haben PA in höheren Dosen potentiell schwerwiegende chronische toxische Effekte (HVOD, Hepatic Venoocclusive Disease). Diese manifestieren sich nach wenigen Wochen bis einigen Monaten. Die Grenzdosis für diese Effekte wird in der Literatur zwischen 0,1 µg/kg KG und 1,0 µg/kg KG angegeben. Das BfR gibt den Health Based Guidance Value (HBGV) mit 0,1 µg/kg KG an (BFR 2013a/b, BFR 2020).
Bei sehr hohen Dosen im mg/kg KG – Bereich können akute toxische Wirkungen bis zum Leberversagen auftreten. Die Grenze zwischen akuter und chronischer Exposition zieht das BfR bei 14 Tagen (BfR 2013b).
Grenzwerte
PA treten als Kontaminanten gleichermaßen bei Pflanzlichen Arzneimitteln wie bei pflanzlichen Lebens- und Futtermitteln auf. Da eine vollständige Vermeidung nach heutigem Stand der Technik nicht möglich ist, können Grenzwerte nicht allein auf toxikologischer Grundlage abgeleitet werden. Für pflanzliche Arzneimittel gilt in der EU eine maximale Tagesaufnahmemenge von 1,0µg/Tag (Erwachsene). Geeignete Spezifikationen abhängig von der Tagesdosis des Wirkstoffs müssen für jedes Produkt individuell abgeleitet werden.
Grenzwerte und Bewertungskriterien für PA in bestimmten Lebensmitteln legt die Verordnung (EU) 2020/2040 vom 11. Dezember 2020 fest. Diese Grenzwerte gelten für ab dem 1.7.2022 in Verkehr gebrachte Lebensmittel. Vor diesem Zeitpunkt rechtmäßig in Verkehr gebrachte Lebensmittel dürfen bis 31.12.2023 abverkauft werden.
Grenzwerte für Pyrrolizidinalkaloide in Lebensmitteln gemäß Verordnung (EU) 2020/2040
| Grenzwerte für Pyrrolizidinalkaloide in Lebensmitteln gemäß Verordnung (EU) 2020/2040 | ||
|---|---|---|
| Erzeugnis | Höchstgehalt (μg/kg) | |
| 8.4 | Pyrrolizidinalkaloide | |
| 8.4.1 | Kräutertees (getrocknetes Erzeugnis), ausgenommen die unter 8.4.2 und 8.4.4 genannten Kräutertees | 200 |
| 8.4.2 | Kräutertees von Rotbusch, Anis (Pimpinella anisum), Zitronenmelisse, Kamille, Thymian, Pfefferminze, Zitronenverbene (getrocknetes Erzeugnis) und Mischungen, die ausschließlich aus diesen getrockneten Kräutern bestehen, ausgenommen die unter 8.4.4 genannten Kräutertees | 400 |
| 8.4.3 | Tee (Camellia sinensis) und aromatisierter Tee (Camellia sinensis) (getrocknetes Erzeugnis), ausgenommen der unter 8.4.4 genannte Tees und aromatisierte Tees | 150 |
| 8.4.4 | Tee (Camellia sinensis), aromatisierter Tee (Camellia sinensis) und Kräutertees für Säuglinge und Kleinkinder (getrocknetes Erzeugnis) | 75 |
| 8.4.5 | Tee (Camellia sinensis), aromatisierter Tee (Camellia sinensis) und Kräutertees für Säuglinge und Kleinkinder (flüssig) | 1,0 |
| 8.4.6 | Nahrungsergänzungsmittel mit pflanzlichen Inhaltsstoffen einschließlich Extrakten, ausgenommen die unter 8.4.7 genannten Nahrungsergänzungsmittel | 400 |
| 8.4.7 | Nahrungsergänzungsmittel auf Pollenbasis | 500 |
| 8.4.8 | Borretschblätter (frisch, tiefgefroren), die für den Endverbraucher in Verkehr gebracht werden | 750 |
| 8.4.9 | Getrocknete Kräuter, ausgenommen die unter 8.4.10 genannten getrockneten Kräuter | 400 |
| 8.4.10 | Borretsch, Liebstöckel, Majoran und Oregano (getrocknet) und Mischungen, die ausschließlich aus diesen getrockneten Kräutern bestehen | 1000 |
| 8.4.11 | Kreuzkümmel (Gewürzsamen) | 400 |
Für pflanzliche Arzneimittel beträgt die maximal zulässige tägliche Aufnahmemenge an PA 1,0µg (Erwachsene). Aus dieser maximalen Aufnahmemenge muss für jedes Arzneimittel, respektive seine Wirkstoffe, eine maximale PA-Konzentration errechnet und durch eine validierte Methode gemäß den Anforderungen des Europäischen Arzneibuchs kontrolliert werden.
Analytik
Arzneimittel
Die Bestimmung von Pyrrolizidinalkaloiden in pflanzlichen Arzneimitteln führen wir unter GMP-Bedingungen gemäß den Anforderungen des Europäischen Arzneibuchs (Ph.Eur. 10.6) durch. Die in unserem Labor entwickelte Methode ist vollumfänglich validiert. Sie erfasst alle gemäß Ph.Eur. in der Arzneimittelanalytik geforderten 28 Pyrrolizidinalkaloide und ist in zahlreichen Zulassungsverfahren behördlich anerkannt. Matrixspezifische Verfizierungen führen wir für Sie gemäß den behördlichen Anforderungen durch.
Lebensmittel
Für Lebensmittel fordert die Verordnung (EU) 2020/2040 die Erfassung von insgesamt 35 Pyrrolizidinalkaloiden. Da dieser erweiterte Scope im Einzelfall zu höheren Ergebnissen und damit potentiell zur non-compliance führen kann ist es empfehlenswert, Produkte und Zutaten schon jetzt nach den Vorgaben der Verordnung zu prüfen. So können Sie rechtzeitig Rezepturen anpassen oder Korrekturmaßnahmen in Ihrer Supply Chain anstoßen.
Wir haben die 14 zusätzlichen Pyrrolizidinalkaloide (z.B. Spartioidin/-NO, Rinderin/-NO oder Usaramin/-NO) daher bereits jetzt in unsere akkreditierte Methode aufgenommen und bieten Ihnen diesen erweiterten Prüfumfang für Lebensmittel ab 1. November 2021 an.
PhytoLab nimmt seit vielen Jahren eine führende Position bei der PA-Analytik getrockneter pflanzlicher Rohwaren und Extrakte und daraus hergestellter Produkte ein. Unsere Experten stehen auch Ihnen gerne zur Verfügung. Sprechen Sie uns an.

PhytoLab GmbH & Co. KG
- Dutendorfer Straße 5-7
91487 Vestenbergsgreuth
Germany
Literatur
BfArM 2016: Bekanntmachung zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die pflanzliche Stoffe bzw. pflanzliche Zubereitungen oder homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten https://www.bfarm.de/SharedDocs/Bekanntmachungen/DE/Arzneimittel/besTherap/bm-besTherap-20160301-pa-pdf.html (Seite besucht am 20.07.2021)
BfR (Bundesinstitut für Risikobewertung) Updated risk assessment on levels of 1,2-unsaturated pyrrolizidine alkaloids (PAs) in foods. BfR Opinion 026/2020 issued 17 June 20201 DOI 10.17590/20200805-100055
Bodi, D; Ronczka, S.; Gottschalk, CH.; Behr, N.; Skibba, A.; Wagner, M.; Lahrssen-Wiederholt, M.; Preiss-Weigert, A.; These, A. (2014): Determination of pyrrolizidine alkaloids in tea, herbal drugs and honey, Food Additives and Contaminants: Part A, DOI: 10.1080/19440049.2014.964337
EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), 2011. Scientific Opinion on Pyrrolizidine alkaloids in food and feed. EFSA Journal 2011;9(11):2406, 134 pp. https://doi.org/10.2903/j.efsa.2011.2406
EFSA (European Food Safety Authority), 2016. Dietary exposure assessment to pyrrolizidine alkaloids in the European population. EFSA Journal 2016;14(8):4572, 50 pp. doi:10.2903/j.efsa.2016.4572
EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain), Knutsen HK, Alexander J, Barreg_ard L, Bignami M, Br€uschweiler B, Ceccatelli S, Cottrill B, Dinovi M, Edler L, Grasl-Kraupp B, Hogstrand C, Hoogenboom LR, Nebbia CS, Oswald IP, Petersen A, Rose M, Roudot A-C, Schwerdtle T, Vleminckx C, Vollmer G, Wallace H, Gomez Ruiz JA and Binaglia M, 2017. Statement on the risks for human health related to the presence of pyrrolizidine alkaloids in honey, tea, herbal infusions and food supplements. EFSA Journal 2017;15(7):4908, 34 pp. https://doi.org/10.2903/j.efsa.2017.4908
EC 2020a: COMMISSION REGULATION (EC) No 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs, last amended by Commission Regulation (EU) 2020/1322 of 23 September 2020
EC 2020: COMMISSION REGULATION (EU) 2020/2040 of 11 December 2020 amending Regulation (EC) No 1881/2006 as regards maximum levels of pyrrolizidine alkaloids in certain foodstuffs. Official Journal of the European Union, 14.12.2020
EMA Herbal Medicinal Products Committee (HMPC): Public statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs) EMA/HMPC/893108/2011
European Pharmacopeia, 2.8.26 contaminant pyrrolizidine alkaloids
Kaltner F, Rychlik M, Gareis M, Gottschalk CH: Occurrence and Risk Assessment of Pyrrolizidine Alkaloids in Spices and Culinary Herbs from Various Geographical Origins. Toxins 2020, 12, 155; doi:10.3390/toxins12030155
Mulder, P.P.J.; Lopez, Sanchez P.; Castelari, M.; Bodi, D.; Ronczka, S.; Preiss-Weigert, A.; These, A. Occurrence of pyrrolizidine alkaloids in animal- and plant-derived food: Results of a survey across Europe. Food additives and contaminants - Part A [35 (1), 2018, S. 118-133]
These, A.; Bodi, D.; Ronczka, S.; Lahrssen-Wiederholt, M.; Preiss-Weigert, A.. Structural screening by multiple reaction monitoring as a new approach for tandem mass spectrometry: presented for the determination of pyrrolizidine alkaloids in plants. Analytical and bioanalytical chemistry [405 (29), 2013, S. 9375-9383]
Schrenk, D.; Gao, L.; Lin, G.; Mahony, C.; Mulder, P.P.J.; Peijnenburg, A.; Pfuhler, S.; Rietjens, I.M.C.M.; Rutz, L.; Steinhoff, B.; These, A.. Pyrrolizidine alkaloids in food and phytomedicine: Occurrence, exposure, toxicity, mechanisms, and risk assessment - A review. Food and chemical toxicology [136, 2020, 111107]